

consort实验室用台式测量仪
可测pH•mV •电导率•比阻抗•盐度•TDS•温度
pH -10...+20 pH
mV ±2000 mV
电导率 0...2000 mS/cm
比阻抗 0...200 MΩ.cm
盐度 0...70 ppt
TDS总固溶解量 0...100 g/l
温度 -5...+105°C
通道数 6个独立测试通道+温度补偿通道
多点校准线性度好(1...5). 精度可选择范围:0.001pH 到0.1pH
自动对11个预定及5个用户确定的PH液进行校准
PH电极0点范围:±999 mV 之间
mV校准,可对ORP(氧化还原)进行测量
精 度选择范围: 0.1mV 到1mV
多点校准线性度好(1...3).
电导率可测范围大: 0.001 µS/cm 到 2000 mS/cm(配不同电极)
可选参照温度 20°C 或 25°C
自动选择合适的范围及频率
用3个预定或用户指定溶液自动测定电池常数
可以锁定初始电导率范围来避免非线性滴定曲线
通过消电极电容及连接线影响,可测量低电导率(不要用长连接线)
读数精度:0.1°C
手动或自动温度补偿
2个pH, mV或电导率输入
6个额外的输入:PH,mv或ION
可设定记录输出
USB 接口可连接到电脑上
RS232 接口可连接打印机或电脑
存储达12000 组值,包括:温度,时间及日期
可将同一表内的数据进行混合
可选用:数据获取软件
防尘、防污外壳
选用的墙壁安装套件可将仪器固定在任何墙面上来节约桌面空间

pH是溶液的酸碱度的值。在纯水中,氢离子(Ht)和羟基离子(OH)的浓度在10-7 M(25°C)时相等。为了方便和有效地定义酸碱度,将pH定义为氢活度的负对数:
pH = -log [H+]
电位法测定pH值的原理来源于能斯特定律。
Nernst发现,当金属物体浸入含有相同金属离子的溶液中时,会产生电位差。Nernst将这种由金属与液体之间的金属离子交换而产生的电位差e定义为:
E = E0 + [RT / nF] · ln [M+]
R=气体常数(R=8.314J/mol - k)
F =法拉第数(F = 96493C /摩尔)
n =金属原子价[M+] =金属离子浓度
T =开尔文绝对温度
EO =正常电位
“正常电位”是当溶液中含有1mol M+/l时,金属和溶液之间产生的电位差。
因为氢离子具有与金属离子相似的性质(都带正电荷),所以能斯特定律也适用于浸入含氢离子溶液中的“氢电极”,此时Nernst的原方程可以改写为:
E = E0 + [RT / nF] · ln [H+]
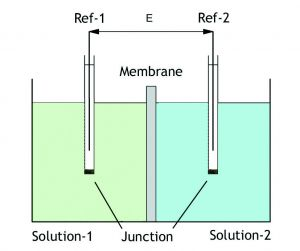
溶液-1待测样品
溶液-2已知缓冲溶液(7 pH)
参照-1盐桥银线(KCI)
参照-2盐桥银线(KCI)
pH值测量系统的要点是一种由特殊的pH选择性玻璃制成的膜,当在其上浸入水时,会形成一层非常薄的H+离子。在高pH值下,这一层的H+浓度较低。然而,在低pH值时,大量的H+离子在该层中扩散。通过测量该层中产生的电势(E),可以计算出相应的pH值。
根据nernst方程(-59.2 mV/pH, 25%C),两根导线之间的电位(E)会随着样品和已知缓冲液之间的pH值差异而变化(-59.2 mV/pH, 25%C)。每根金属丝周围都有一个盐桥,通过使用湿结来保持稳定的电气性能,防止金属与溶液直接接触。